本帖最后由 老马 于 2012-1-22 15:28 编辑
8 C) M$ I4 o. t" @0 n
; z: Y! U% `4 A7 l4 E0 h肿瘤节律化疗研究进展
( Y( V* Q- y7 I郑州大学第一附属医院 李醒亚
% Y1 H. k7 {) E. b' ^+ q9 M7 L2 i第十一届全国临床肿瘤学大会暨2008年CSCO学术年会
. B( e1 G J; x 肿瘤化疗已经走过了半个多世纪,随着新药不断涌现,应用日趋广泛并发挥着日益重要的作用。在未来的相当一段时间内,化疗仍将是癌症的主要手段之一。癌症的全身治疗一直是以应用细胞毒药物进行化学治疗为主,并且绝大多数药物通过损伤DNA或抑制微管功能来抑制或杀伤增殖旺盛的细胞。河南省肿瘤医院内科李醒亚- M. \( Z! r; D6 R5 W: {1 H
* w2 S; _% l: X; \
目前的常规化疗一般选用药物的最大耐受剂量(MTD),原则是用尽大剂量和尽短的间歇,尽可能多地杀灭肿瘤细胞,避免其毒性危及患者生命。MTD化疗法在每两个周期间有2~3周的间歇以供机体恢复。MTD化疗可使大约半数肿瘤得以完全或部分退缩,但很少能治愈或显著延长癌症患者生存时间,并且常伴毒副反应,如骨髓抑制、脱发、黏膜炎及生育能力破坏。生长因子及止吐药虽能减轻这些毒性反应,但同时明显增加了医疗费用。# a3 U8 J0 x+ L+ C: u9 l, f. M
1 节律化疗的提出
6 T6 A7 ~' [. V4 X/ }6 M 与短期给予毒性大的MTD相对应的另外一种化疗给药方法是小剂量高频度用药,称为“节律化疗”,节律化疗不仅能降低毒性反应,而且能提高抗肿瘤效果,并且适合与靶向药物或低毒性抗癌药物合用。4 N) ]% F6 B: }$ z' T# o# Z
' q! o) y6 l) { y$ h
现在有一种全新的观点,认为更持续或高频率给予比最大耐受剂量(MTD)小得多的单次剂量更有效——不仅能降低毒性反应,而且能提高抗肿瘤效果。此外,这种方案适合与靶向药物及毒性相对低的抗癌药物合用。最新的定义将此称为“节律化疗”,即高频率甚至每天一次给予比MTD低得多的化疗药物,不伴较长的间歇期。; G8 Y& C: d s( @: o) E1 p3 {
' g, B0 }$ y. p我们知道一些大剂量化疗合并自体骨髓干细胞移植并未能象预期中的那样明显延长生存期,并且价格昂贵、毒性大、风险大。现在有一些观点认为化疗“频率越高越好”及“剂量越小越好”。0 W2 p/ Q7 S% m
) h0 \/ D* h$ c8 m U6 e “剂量密度”(dose-dense)化疗是在短间隔(如每2周一次)内给予一种或多种化疗药物,这种疗法已在乳腺癌和非霍奇金淋巴瘤的Ⅲ期随机临床试验中显示出良好效果,所用药物的总量与MTD基本相当。因此,如果隔周一次给药比每3周一次效果好,为什么不尝试每周一次甚至每天一次的给药方法呢?近来,越来越多的医生开始每周一次应用紫杉醇类、CPT-11等治疗乳腺癌和小细胞肺癌。一些口服药物如环磷酰胺、VP-16胶囊、替莫唑胺、5-FU衍生物(替加氟、卡培他滨和S1)等间歇性治疗也逐渐受到青睐,这些给药观念在某些方面与节律化疗都很相似。
) c: |1 t5 ]4 r# }3 U4 p& v9 o4 C- l
节律化疗可以看作是剂量密度化疗的另一种方式。由于节律化疗减轻了毒副反应,因而不需要生长因子支持以加速骨髓抑制的恢复。更重要的是,虽然累积给药剂量较低,但是节律化疗的抗癌效果,至少在延长生存期方面,比传统的MTD方案要好得多,两种化疗的特点列入表1。' b2 O0 [ U! {2 M) X" l8 {
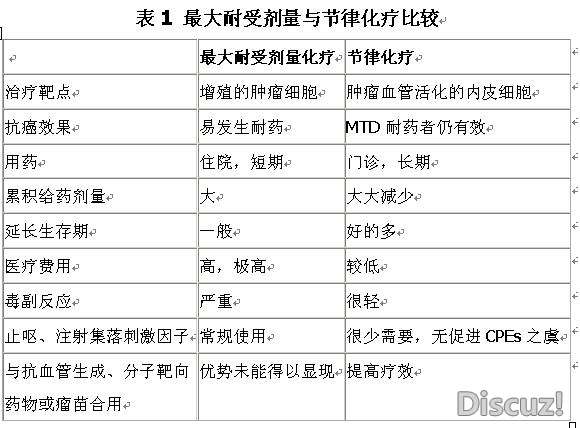 2 ]: S- q5 H0 a% q2 {, M
2 ]: S- q5 H0 a% q2 {, M
& r* @; j/ J! H' }% a7 T- A2 节律化疗的抗血管生成效应
2 |+ D) z7 }, v- r! X, N; h( S. ?( K" v% C! y# K7 }; J# O" i
一般认为化疗药物是通过破坏肿瘤细胞而达到治疗目的,但是,我们却长期忽视了化疗对肿瘤组织中的间质成分(特别是血管内皮细胞)的作用。其实,大多数肿瘤化疗药物都有阻断肿瘤新生血管形成和破坏已形成血管的作用,近年来才引起人们注意。化疗的抗血管作用最早是在1991年被提出来,Baguey等把在体外经长春花碱诱导耐药的肿瘤细胞同时接种到小鼠皮下和腹腔,再用长春花碱治疗能使90%以上的实体瘤坏死,但腹水中肿瘤细胞的生长却没被影响。之后其他学者用鸡胚尿囊膜(CAM)和内皮细胞等体外和体内方法进行研究,发现长春新碱、阿霉素和紫杉醇等相当一部分化疗药物都具有抗血管生成作用。1 Y& o! T6 Q3 u l. _2 F
9 t; ?7 s- w! a1 {: x: v
研究发现肿瘤血管的内皮细胞增殖速度与骨髓细胞相当,细胞周期时间为5天左右,而正常组织内皮细胞长达1,000天(3~4年)。另有研究显示,内皮细胞对细胞毒药物的敏感性是瘤细胞的10~10,000倍,每次化疗后最先发生凋亡的是肿瘤血管内皮细胞。所以化疗是通过对肿瘤细胞和血管内皮细胞两个靶点的杀伤而发挥抗肿瘤作用,药物在大量杀灭肿瘤细胞的同时,也通过杀死或抑制肿瘤组织血管上活化的内皮细胞而破坏肿瘤组织的血供,但是,我们却长期忽视了化疗的抗血管生成作用。1 T- o5 s$ s7 F) \
- F( \6 ^- D; a
与肿瘤细胞靶向治疗相比,血管靶向治疗的优势在于:1血流中的药物先与内皮细胞接触,然后,其中有部分弥散到血管外的瘤细胞;2细胞过度增殖使内皮细胞与癌细胞的比例可高到1:100(正常组织1:1~2),通过破坏血供去抑制肿瘤可做到事半功倍;3内皮细胞系二倍体而不会发生耐药突变;4血管靶向治疗不依实体瘤类型而异,对多种肿瘤都有效。+ f# u- c: Z1 H+ v2 |/ A, e
* N% }. m3 S! _! D3 } m; a 传统化疗追求最大幅度地杀灭肿瘤细胞,所以药物常用至MTD,在每次化疗之间有2~3周或更长间歇期,以供机体修复骨髓抑制和黏膜损伤等毒性反应。目前认为在化疗间歇期,化疗引起的血管内皮损伤由骨髓来源的EPs得以修复,这样就会掩盖或削弱了化疗的抗血管生成作用。近年来在动物的移植瘤化疗研究中发现,节律化疗能使受损的血管内皮失去修复的机会,从而明显加强了抗血管生成作用。因此,有学者把节律化疗称为“抗血管生成方案”或“抗血管生成化疗”。8 y0 q, T; {: P- q
. F$ h% n& N [: v0 i: q 节律化疗使受损的血管内皮得以修复的机会将大为减少,从而加强了抗血管生成作用。Browder的实验显示,已对MTD的环磷酰胺(CTX)耐药的小鼠移植瘤,尽管瘤体已经很大,改用节律化疗后,仍能使其达到完全缓解。也就是说,肿瘤细胞获得耐药后,内皮细胞仍对化疗敏感,通过转换治疗靶点仍能使肿瘤得以控制。
9 R8 b" f1 |) n% G7 X. ]3 节律化疗的抗血管生成作用的机制
& e6 u' _ O/ j
2 k, S* v6 F3 Y9 j 研究发现节律化疗可通过诱导产生内皮细胞特异的抑制因子比如血小板反应素1(TSP1)发挥作用。TSP1通过与内皮细胞上的CD36分子结合而阻止其增殖并诱导凋亡,因其他细胞如骨髓和毛囊没有CD36表达而不会受到影响。TSP1还能结合VEGF而阻断其诱导血管生成的活性。$ Z; E/ q% ^8 @6 w
6 ?1 _6 w& u# y6 w/ { 如前所述,节律化疗的主要优势在于阻止发生于MTD化疗间歇期的肿瘤血管修复。这一强大而独特的修复过程的基础是骨髓来源的循环前体内皮细胞(CEPs)。CEPs在早期胚胎中脉管系统的发育及肿瘤的血管生成过程发挥关键作用,尤其有助于形成“系统化”的脉管系统。有报道称,新生血管多达50%的内皮细胞来源于CEPs。节律化疗很可能是通过抑制破坏骨髓来源CEPs而发挥抗血管作用。
0 D; r! _5 g; X k: i9 O5 o0 |
8 c$ O2 v2 z% ` 节律化疗在一些情况下能刺激免疫系统,使得它可以与肿瘤疫苗或其他免疫疗法合用;节律化疗也可能对肿瘤细胞有一定直接作用;能够防止发生于MTD化疗间歇期的肿瘤细胞分裂的反弹。
$ V' C7 W0 |3 T8 r; y$ D% ~" Q9 o- m% C0 L: _6 i M% \7 B
荷瘤小鼠经MTD化疗后血液循环中升高的CEPs水平迅速下降,到化疗间歇期又快速大幅反弹。相反,当每周一次低剂量或通过饮水持续给予CTX时,CEPs的数量及生存能力逐渐下降且不会出现反弹。" S) }" }' T" {& ^ v9 Y
" u5 H0 z# C5 A- K: Q$ W
在此特别要说明的是:Epo和G-CSF通常分别用于促进病人从MTD化疗导致的贫血和骨髓抑制中得以恢复,因为它们促进骨髓前体细胞动员进入外周血并进而分化为成熟的红细胞和白细胞,但同时也加速CEPs的动员,CEPs反过来又刺激血管生成,导致肿瘤生长。这一点可以解释为什么在一些临床试验中标准化疗后应用Epo的病人反而有更坏的结果,特别是在生存期方面。
: C+ c) s/ o6 D+ s2 Q 图1 目前肿瘤节律化疗作用机制的设想模式图(略)
$ r, [* A$ O. m/ n 4 节律化疗的其他抗肿瘤作用
( p# y* ~0 u# f L: g
0 j8 f/ \3 t# {6 j* N' v1 y0 P$ J 节律化疗除了上述的抗血管生成作用以外,在很多情况下发挥着直接的抗肿瘤作用,特别的临床上部分患者的肿瘤经节律化疗后发生明显的退缩。" k* g( [3 x9 A6 H( v9 |: \
3 R z& T5 V* O' N* \6 e8 {# `' | 除了前述肿瘤的新生血管上的内皮细胞对化疗特别敏感外,肿瘤间质中的炎症细胞也同样对化疗敏感。除内皮细胞以外的间质细胞(如巨噬细胞、粒细胞、淋巴细胞和成纤维细胞等)在肿瘤侵犯、脉管生成、转移的各环节、局部微环境形成和免疫逃逸等过程都发挥着重要作用,尽管目前我们没有足够的证据,现有的研究表明节律化疗很可能通过抑制肿瘤间质的一些成分而达到抗肿瘤作用。# t* e. B* L# R6 _
/ P1 ? O5 o) d$ D
转移是恶性肿瘤有别下良性疾病的重要特征之一,也是治疗失败的主要原因和目前肿瘤治疗所面临的重大挑战。近来在我们的实验中发现,使用一定强度的节律化疗在适当的时机可以明显控制甚至彻底阻断小鼠肿瘤的远处转移,但不能控制原发灶肿瘤的生长。因此,可以说我们对节律化疗的抗肿瘤的作用又有新的认识,深入开展这方面的研究不仅有重要的现实意义,对探索肿瘤转移的机制也将会提供有价值的观察和干预的方法。
) w0 z1 P |2 A8 u& D5 节律化疗的临床试验
, g( o0 p1 [& c2 x h0 C
3 ?) R& W1 u: ]# e7 L 验证节律化疗尤其是其与抗血管生成药物合用的潜在优势的Ⅱ期临床试验近年来逐渐增多。多数试验应用CTX,每天一次口服给药,甚至不间断服用两年,有的应用甲氨蝶呤(MTX)每周一次连续两天低剂量口服给药。试验的靶向药物包括COX-2抑制剂如塞来昔布,每天一次给药或人源化抗VEGF单抗,每两周一次静脉给药。Colleoni et al报道,治疗有效的病人血清VEGF水平下降;Bertolini et al报道,接受每天一次低剂量CTX治疗的淋巴瘤和乳腺癌病人血液中CEPs数目下降。已经证实,节律化疗在一些情况下能刺激免疫系统,因此,可以与肿瘤疫苗或其他免疫疗法合用;另一些临床前研究发现,CTX节律化疗能提高免疫疫苗的疗效。节律化疗也可能对肿瘤细胞有一定直接作用,持续节律化疗还能防止MTD化疗的间歇期肿瘤细胞分裂加快,数目迅速回升的这种“反弹”。
$ k0 Q% T6 E$ P# \* x ?+ Z% T b& \1 F) h, l
节律化疗在很多方面同治疗儿童恶性肿瘤的长期维持化疗方案相似。比如对于急性淋巴母细胞白血病,在标准化疗方案及大剂量化疗的诱导缓解之后,每周一次口服低剂量的MTX及每天一次6-巯嘌呤持续三年以上。儿科肿瘤专家发现,每天一次给予CTX联合每周一次长春花碱类(如VCR或VLB)对神经母细胞瘤等病人有效,每周一次给予长春花碱类药物在Wilms瘤及横纹肌肉瘤的治疗中发挥着重要作用,进展期纤维瘤病也可能被低剂量的VLB和MTX所控制。; C) `; ]+ C+ i; [ B5 a
+ I- N- T' L: O! O" \
口服嘧啶类药物,UFT,一种可代谢为5-FU和GBL、GHB的药物前体混合物,是又一类可用作节律化疗的药物。2004年日本学者在新英格兰医学杂志报导了早期肺腺癌术后每日口服低剂量优福定(UFT)连续2年的大样本(1000例)随机研究,用UFT组生存期显著延长且副作用小。在其他实验研究中发现UFT代谢产物5-FU、GBL及GHB能抑制内皮细胞生长和迁移并有抗血管生成活性。特别是在连续低剂量用药时。这一药物的抗血管生成作用是否有助于提高它的临床疗效?其疗效是否会因合用靶向抗血管生成药物而提高?这些问题尚需进一步研究来回答。然而,UFT用于肺癌病人的试验显示,长期口服低剂量化疗药物可作为早期复发微小肿瘤的一种辅助治疗方法。
- b- W2 J3 R, j- o
, N/ l2 F4 B, d* Z' e6 O( F4 x- k 当然,还需进一步试验来判断其他可以每天一次长期口服给药的化疗药物是否也有抗血管生成作用及这一作用是否有助于提高其抗瘤效应,如拓扑异构酶抑制剂VP16或烷化剂替莫唑胺。在治疗恶性黑色素瘤和NHL时,某些情况下也长期(4-5周)口服低剂量的VP16、razoxane或替莫唑胺,这也可算是姑息治疗,因其毒性低,所以可用于不能耐受MTD化疗的老年病人,并且初步证据显示,这些方案的抗血管生成作用有助于提高他们的抗癌效果。其他方法包括将可注射的化疗药物包裹于针对内皮细胞的脂质体内,以延长药物的半衰期。* c M2 C7 A H& C$ {0 N
- j" H; X0 K! t: |$ ]+ Y 现将近年来主要的节律化疗临床试验举例如下:
- q. x* S/ k4 |# D# Y( h3 x1 p! z% R9 d( F
64名都接受过一线、二线或三线治疗的复发性晚期乳腺癌病人,每天一次低剂量CTX口服,每周两次MTX口服,试验结果显示总有效率为32%,其中2例完全缓解,10例部分缓解,12例病情稳定长达6个月以上49。没有出现严重毒副反应。(Colleoni M,2002)
. {) y4 H3 Z- D# i. N
8 k8 v G8 u4 f1 A/ R4 j 32例晚期雄激素非依赖性转移前列腺癌患者。每天口服CTX 50mg/d,地塞米松(报道有一定的抗血管生成作用)1 mg/d。68%病人血清PSA水平下降50%以上(29%患者PSA下降大于80%,39%的下降50%-79%)小于50%的占6%,26%的人SD。(Glode LM,2003)。; c2 c+ W2 p. i+ y4 d3 W7 R; X
# P; `, I, w4 I9 N( F# Y
22例曲妥珠单抗治疗失败的转移性乳腺癌,MTX2.5 mg,bid d1,4/week, CTX 50mg/d, 曲妥珠单抗每3周6 mg/d,18%PR,46%SD,36%PD (Orlando L,2006)7 Q3 u( u5 j9 z
$ r# r( J/ B4 Z 114例老年乳腺癌,T2-4N0-1,试验组CTX 50mg/d+来曲唑2.5mg/d共6个月;对照组:来曲唑。试验组OR 87.7%,对照组OR 71.9%。(Bottni AD,2006) m7 J& R$ j5 u; p1 d9 Z
" a- k) G& T0 L, c1 s, d: n
复发性难治性非霍奇金淋巴瘤,口服CTX 50mg/d, 塞莱昔布 400mg bid,37%CR+PR, 22%SD。(Buckstein,R2006)
5 E# T$ f) }" B
2 R+ a( A& U: `( u! ?7 u% h 47例难治性实体肿瘤,口服CTX 50mg/d, rofecoxib 25mg/d, 长春花碱3mg/㎡,4%CR, 9%PR, 17%SD。(Young SD,2006)
- B. @# u8 {7 L; F9 q+ {) u1 `' a0 m
难治性多发性骨髓瘤37例,CTX 50mg/d, bid 共21天,沙利度胺200mg/㎡, 强的松50mg qod. 每28天重复,OR62.9%, CR20%,接近CR5.7%,PR37.1%, SD22.9%。(Suvannasank ha A,2007)
: l, H0 k% y; s- Z7 B
, f) W9 Y( B) E- o: E! w' Q7 [8 W 49例结肠癌,低剂量的CPT-11(40mg/㎡,d1,8,15 Q28d)UFT335 mg/㎡/day,共治疗6个月,用于复发高危结肠癌的辅助治疗。24 例IIIb期的术后的5年生存率为73%,25 例远处转移者术后的5年生存率为62%。不良反应轻微。(Ogata Y, 2007)
5 I/ H& k- [" d |# k5 J: ?6 o* r2 r7 U' q) d# G' g0 g& `' A* D" A
24例非激素依赖的转移性前列腺癌,其中17例曾接受多西他赛、雌二醇氮芥等的化疗,CTX 500 mg/sqm iv d1后,CTX 50 mg po qd, 地塞米松 1 mg po qd, 塞莱昔布200 mg po BID , 持续口服。结果:8例(33.3%)PSA 下降> 50%其中3 pts (12.5%)降至正常水平,9例 (37.5%) PSA稳定达2个月以上。总计有17例 (70.8%)PSA控制(PSA 下降> 50%+PSA 稳定). 中位PSA进展时间为3.5 (1-17) 月,中位PSA反应时间为6.5 (2-9)个月,没有3-4度不良反应。检测TSP-1水平上升并有VEGF 水平下降。(A. Fontana, 2007)
, m' T- y' P6 w7 Q: Z: v
# V7 }6 Y% y- h' a$ z$ i( P g9 J 45例曾经化疗过的进展期或复发性结肠癌,S-1 80 mg/m(2)/d, 每连续口服5天休2天,CPT-11 60 mg/m(2) d1, 8, 15,每28天重复的节律化疗。1例CR,21例PR,RR48.9% (95% CI, 33.7%-64.2%),中位PFS为7.6个月,3级以上毒性4.4%-8.9%。作者认为生存期与传统化疗相当,并且更为安全。(Y. Ogata, 2008)
9 S$ ?( I, Y, F+ f1 h
. A5 [6 ^ k& ]$ Z T" ~. k 14例可评价毒性和疗效的转移性非激素依赖的前列腺癌,接受多西他赛60 mg/m(2) iv 每3周重复,,强的松5 mg BID口服,环磷酰胺 50 mg每天一次口服,塞莱昔布200 mg BID口服。多西他赛中位治疗8,5 (1-12)周期,口服药物183 天(18-636天)。PSA下降50%以上的有11例(78%),其中6例的(43%)PSA获CR,3例(21%)疾病SD;PSA的中位进展时间为7.7 (3,7-10,3)个月,到发稿时有4例(28%) 疾病出现进展。3度的中性粒减少和腹泻各1例,无4度毒性。( A. Fontana,2008)% T6 j. A: n0 S$ R
: O( C. D- Q$ } 13 例曾经1或2个周期(分别为3人和7人)和7个以上周期(2人)化疗的转移性结肠癌患者,都曾接受过贝伐单抗治疗。节律化疗方案为:CTX 25-50 mg PO QD,贝伐单抗5mg/kg IV q 14 d, , 格列卫400 mg PO QD. 每28 天重复。2例获SD维持6个月以上,1例肿瘤按RECIST标准缩小19%。(E. K. Bergsland, 2008)' J t/ X% O0 `+ D. D7 [4 ^" {. [
+ @& V) W1 }: N4 U' R6 x
8例经过5 (2-7)个周期反复化疗过的转移性乳腺癌,用舒尼替尼联合CTX/MTX节律化疗,初步结果显示耐受良好且有一定的疗效。(J. Lyandres, 2008)
( s. w+ F4 z5 s' r3 I, ?& r1 `1 B( p3 @
10例病理证实、不可切除的胰腺癌,经紫杉醇和吉西他滨(PaG ,P: 60mg/㎡, G: 800-1,000 mg/㎡) 每周一次共12周,然后每周POLF (紫杉醇 60 mg/㎡, 奥沙利铂 50 mg/㎡, 亚叶酸钙 20 mg/㎡,5- 氟尿嘧啶425 mg/㎡) 只少12周。目前多数患者还存活,IV期的生存期已超过9个月。12周PaG后2例PR,完成所有化疗后6例PR,1例SD/PR,1例SD,2例PD。III级的腹泻和神经毒性各1例。(B. M. Chue,2008)' M; b" |4 ~/ E' s. s9 m @! j
" z# m! o8 j$ J3 c6 v; s4 V 21 例IV期NSCLC经一线化疗失败患者,多西他赛25 mg/m(2) d1, 8,,15, Q4w, trofosfamide 50 mg/day.中位化疗3周期,OR 19%, MOS 6.9 月, MPFS 2.9 月, 1年生存率 28.6%, 2年生存率 7.1%.没有IV级毒性.(Görn M,2008)8 t3 n9 m1 |, ^$ y; b1 ?7 v
9 O" Y: U# h' }# H) T4 N
75例曾接受过2个或2个以上方案化疗的淋巴瘤患者,每天口服强的松20 mg,CTX 50 mg,VP-1650 mg和丙卡巴肼50 mg,当WBC<3.0 x 10(9)/L时暂停,待恢复后再继续治疗。根据患者耐受情况,或隔天用药或间段用药(如每周用药5天)。总有效率69%,其中CR36%,PR33%。中位治疗时间17个月。患者对化疗耐受良好。组织学为惰性的淋巴瘤要比侵袭性的疗效好。22 个被反复化疗过的复发的套细胞淋巴瘤,CR46%,PR36%。(Coleman M, 2008)
8 A/ {( y4 s' k" R1 ~; Y. G' x5 H
2 k8 y/ a5 G5 _, [1 B$ c6 I# `1 A/ [ & q5 p+ E: g5 z4 f9 Q% ?
& W$ q2 \1 ~0 }$ y6 未来的方向
" [( j, M0 X( j8 H
; {! G+ m$ y* ~& ^. p6 N% ~ 由于大多数复发、转移的恶性肿瘤难以治愈,又鉴于MTD化疗的明显毒副反应,化疗方案的组成、用药剂量、频度和周期数都在逐渐发生改变。节律化疗不仅是用药方式上的改变,也是肿瘤治疗策略的转变和药物治疗靶点的重新认定。化疗除了能直接杀伤肿瘤细胞外,也具有对抗肿瘤新生血管、控制肿瘤转移等方面的作用,特别是低剂量、高频度的节律化疗,因能持续抑制肿瘤血管内皮而实现更好地发挥化疗的抗血管作用。充分发挥化疗对肿瘤及其新生血管的双重靶向作用,将有效地提高其治疗的潜能。
! {" [" X' m8 [: R1 V! t# ^/ A+ Z6 ~& ~5 ~ G6 i5 N3 w* i0 s
虽然节律化疗具有不少优势,与靶向抗血管生成药物(包括多靶点的靶向药物)合用能更好地发挥作用,但要充分发挥其治疗的潜能,还有很长的路要走。目前最关键的问题时确定化疗药物的最佳剂量和最佳给药程序。化疗有两种主要的给药方式,就好比收音机的波段,“AM”意味着提高剂量,但需要较长间歇期,而“FM”意味着降低每次给药剂量。FM有多方面的优势,其中包括减少急性毒性反应及与靶向药物合用于长期治疗。因此面临的挑战之一就是确定能控制靶细胞的最小剂量及和最佳给药频度,以充分发挥其治疗的潜能。许多分子靶向药物没有剂量限制性毒性,治疗的价值主要体现在生存的延长而不在瘤体的退缩,希望能通过监测分子或功能性标记物来指导剂量调整和疗效的评价,选择和监测抗瘤活性和疾病的控制。节律化疗也是如此,可通过监测血清或血浆中循环TSP1 、CEPs或循环内皮细胞(CECs)水平的变化评价疗效并指导治疗,并有助于确定药物的最适剂量。
c; N- z" L# K' I- }$ b T
! K: t, I7 {: Q6 h 面临的第二个挑战是,当给予能损伤DNA的药物或其他基因毒性药物时,将来是否会发生延迟性毒性反应,包括第二肿瘤的发生。在晚期患者并成为问题,但在作为辅助治疗用于早期且能治愈的病人时,自己是一个不容忽视的一个重要问题。目前这方面的研究资料不多。连续六周应用低剂量替莫唑胺的病人会出现免疫抑制性T淋巴细胞减少症。连续两年服用低剂量UFT的早期NSCLC病人的毒性反应较低,仅10/482(2%)的病人出现了3级毒性反应。
. R8 o8 F, K# m c; i- n
" p$ W# _% E3 Z9 ] 令人感到欣慰的是,许多正在进行的前瞻性随机临床试验将会更好的阐释节律化疗的潜在优势,特别是与新的分子靶向药物合用时。有待解决的问题包括进一步明确哪些药物更适合于节律化疗,怎样联合或序贯应用以及长期应用时出现耐药的机制。另外,确定哪些肿瘤最适合这种治疗也很重要。已有证据表明,乳腺癌和中枢神经系统的肿瘤适合用节律化疗。在未来的几年里,随着节律化疗的基础研究的深入和临床试验的展开,我们将会找到这些问题的答案。
: N- u/ n) s( v( L% p1 l9 O( H1 ^3 Z- s n
+ ~) E% s. Q5 a 节律化疗也在改变着人们对化疗及综合治疗的认识。我们在动物试验中发现早期给予节律化疗能有效控制肿瘤的转移,也提示早期肿瘤术后的辅助性节律化疗会在降低复发和转移方法发挥应有的作用,同样与传统化疗、放疗等联合也可能会提高疗效。节律化疗的出现有可能带来肿瘤化疗的变革,并有可能成为肿瘤治疗史上的一个里程碑。化疗从过去单纯肿瘤细胞靶向治疗作用转变到肿瘤细胞和血管内皮细胞双重靶向治疗作用,将来有可能会根据药物对两个靶点的作用差异而重新评价化疗药物,并且有可能改变传统的用药形式、联合方案、评价标准、适应证的选择及综合治疗规划等。! r/ \8 z4 a) w2 V" Q
|